 Wyznaczanie temperatury wrzenia wody w zależności od ciśnienia.
Wyznaczanie temperatury wrzenia wody w zależności od ciśnienia.
(111)
OPIS TEORETYCZNY
Wrzenie jest formą parowania, czyli przejścia ciała ciekłego w parę, Zanim więc podam
dokładną definicję wrzenia scharakteryzuję krótko sam proces parowania oraz własności
własności pary.
Co to jest parowanie? Jest to po prostu odrywanie się pojedynczych cząsteczek od cieczy
i przechodzenie ich do powietrza. Ponieważ w cieczy cząsteczki związane są ze sobą tzw
siłami międzycząsteczkowymi, aby cząsteczka mogła "wyparować", czyli opuścić ciecz musi być spełnionych kilka warunków:
Cząsteczka musi:
- znaleźć się przy powierzchni cieczy,
- posiadać energię kinetyczną większą od energii potencjalnej przyciągania międzycząsteczkowego,
- prędkość cząsteczki musi być skierowana na zewnątrz cieczy.
Ponieważ ciecz opuszczają w procesie parowania głównie cząsteczki o energii większej niż przeciętna energia pozostałych cząsteczek,
to temperatura cieczy w skutek parowania obniża się. Ilość energii odbierana
od cieczy w procesie parowania określona jest przez tzw ciepło parowania.
Ciepłem parowania rnazywamy ilość ciepła jaką należy dostarczyć do cieczy,
aby doprowadzić do wyparowania jednego kilograma tej cieczy bez zmiany temperatury tej cieczy:
Q = m r
Q - ilość ciepła dostarczona do cieczy (uniesiona przez cząsteczki, które wyparowały)
m- masa cieczy;
r- ciepło parowania
Należy zauważyć w tym miejscu, iż parowanie zachodzi, z różną intensywnością, we wszystkich temperaturach i, na ogół,
temperatura ta nie jest w trakcie parowania stała.
Na prędkość parowania wpływają następujące czynniki:
- temperatura cieczy (im wyższa temperatura, tym większa energia kinetyczna cząsteczek, tym szybsze parowanie)
- ciśnienie pary (im wyższe ciśnienie, tym gęściej upakowane są cząsteczki i tym mniej jest miejsca dla innych cząsteczek)
- wielkość powierzchni cieczy (im większa powierzchnia, tym więcej cząsteczek może równocześnie wydostać się z cieczy),
- ruch powietrza nad cieczą ( cząsteczki, które już wyparowały są porywane i robią miejsce dla innych cząsteczek),
- rodzaj cieczy (różne są wielkości sił międzycząsteczkowych w różnych cieczach).
Najczęściej spotykanym przypadkiem występowania pary jest obecność
cząsteczk pary wodnej w powietrzu. Obok cząsteczek azotu, tlenu i innych, występujących w miejszej ilości
substancji, współtworzą one powietrze. Występuje jednak istotna różnica. Otóż ilość cząsteczek wody
w jednostce objętości powietrza (tzw wilgotność bezwzględna) jest bardzo zróżnicowana i zależy od wielu czynników, ale
przede wszystkim od temperatury powietrza. W określonej temperaturze maksymalna zawartość pary wodnej
w powietrzu jest ograniczona. Woda w zamkniętym naczyniu o stałej temperaturze paruje tak długo, aż stanie się parą
nasyconą, czyli jej ciśnienie osiągnie (w danej temperaturze) maksymalną wartość. Dzieje się tak w chwili, gdy cząstek wody
w powietrzu jest tak dużo i są tak blisko siebie (a przy tym mają za małą prędkość, aby pzy spotkaniu odbić się od siebie), że zaczynają się"sklejać" ze sobą. Następuje skraplanie. Wytwarza się stan równowagi dynamicznej. W każdej chwili tyle
samo cząstek wyparowuje, co skrapla się. Im wyższa temperatura, tym ciśnienie pary nasyconej
jest wyższe i tym więcej pary może znajdować się w powietrzu.
Ze zjawiskiem występowania pary nasyconej spotykamy się np. w silnie zaparowanej łazience,
w której następuje skraplanie wody na chłodniejszej niż otoczenie powierzchni lustra lub metalowych częściach armatury.
Powyższe, dość długie wywody były niezbędne, aby wyjaśnić wreszcie sam proces wrzenia.
Wrzenie, definiuje się jako proces parowania, który zachodzi w całej objętości cieczy i przebiega w stałej(przy ustalonym ciśnieniu) temperaturze.
Wyjaśnię teraz, jak dochodzi do procesu wrzenia i dlaczego zależy on od ciśnienia:
Wewnątrz cieczy znajduje się zawsze pewna ilość cząsteczek, które mają wystarczającą energię
aby wyparować, ale nie znajdują się przy powierzchni cieczy. Natrafiają one jednak na mikroskopijne pęcherzyki powietrza, które
zazwyczaj znajdują się w cieczy. Mogą to być też niejednorodności ułożenia cząsteczek względem siebie związane z obecnością
różnorodnych cząsteczek innego rodzaju niż cząsteczki danej cieczy.
Do tych pęcherzyków lub wolnych przestrzeni międzycząsteczkowych
mogą wyparowywać cząsteczki o odpowiednio dużej energii. Cząsteczki te w miarę wzrostu temperatury cieczy uzyskują
coraz większą energię kinetyczną. Nie mogą jednak "rozepchnąć" go, bo w pęcherzyku panuje
cały czas ciśnienie takie jak nad powierzchnią cieczy (plus oczywiście ciśnienie hydrostyczne na danej głębokości).
Dopóki temperatura jest za niska, aby do pęcherzyka dostało się ilość cząsteczek zdolnych go rozepchnąć,
para w pęcherzykach jest cały czas nasycona i nadmiar cząsteczek skrapla się.
W końcu jednak dochodzi do tego, że temperatura osiąga wartość,
przy której ciśnienie pary może przekroczyć (zanim dojdzie do nasycenia), choćby minimalnie, ciśnienie zewnętrzne.
Od tej pory więcej cząsteczek może wnikać do pęcherzyka, pęcherzyk rozrasta się
i wypychany jest przez siłę wyporu na powierzchnię cieczy. Towarzyszy temu odgłos pękających pęcherzyków
-stąd charakterystyczny szum gotującej się wody.
Proces wrzenia zachodzi cały czas w stałej temperaturze, jest więc tzw przejściem fazowym pierwszego rodzaju.
Dopóki cała ciecz nie zamieni się w parę temperatura tej cieczy nie ulega zmianie.
Wyjątkowo może dość do tzw przegrzania cieczy. Dzieje się tak, gdy wewnątrz cieczy nie ma centrów kondensacji,
czyli pęcherzyków powietrza lub zanieczyszczeń (np. dobrze przedestylowana woda). Wtedy cząstki wewnątrz cieczy uzyskują dużą energię kinetyczną
kosztem dostarczanego z zewnątrz ciepła, lecz nie mają gdzie wyparować. Ciecz może wówczas osiągnąć temperaturę znacznie przekraczającą
temperaturę wrzenia. Wystarczy wówczas jednak niewielkie zaburzenie- wstrząśnięcie lub zanieczyszczenie cieczy, aby nastąpiło
gwałtowne, niemal wybuchowe wrzenie cieczy.
Jak wykazałem powyżej, temperatura wrzenia cieczy zależy od panującego na zewnątrz cieczy ciśnienia.
Przeprowadzone u nas w labnoratorium doświadczenie obejmuje niewielki zakres ciśnień i temperatur. Warto uświadomić sobie jak
ta zleżność przebiega w szerszym zakresie, tym bardziej, że dla wody przebiega ona nieco inaczej niż dla pozostałych cieczy.
Zachowanie wody w szerokim zakresie ciśnień i temperatur przedstawia poniższy wykres, zwany wykresem fazowym.
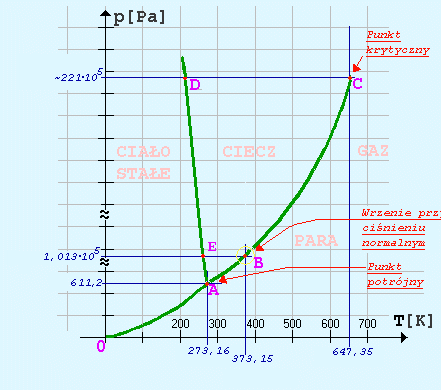 Linie ciągłe na tym wykresie oznaczają odpowiednio warunki, w których następuje :
Linie ciągłe na tym wykresie oznaczają odpowiednio warunki, w których następuje :
- 0-A - sublimacja lub resublimacja,
- A-C - wrzenie lub skraplanie,
- A-D - topnienie lub krzepnięcie.
Uwaga! Wykres jest tylko schematyczny,
gdyż nie zostały zachowane proporcje
i np. dcinek A-D powinien być praktycznie
pionowy ze względu na bardzo małą ściśliwość wody, a różnica temperatur między
punktem A i E wynosi
273,16K - 273,15K =0,01K (sic!)
Współrzędne E(273,15K; 1013hPa)
Charakterystyczne na tym wykresie są punkty:
- A - tzw punkt potrójny. Jeżeli zapewnimy tekie warunki (dla wody jest
to p = 6,16Pa = 4,62 mmHg oraz T = 273,16K = 0,01oC),
to ciało stałe, ciecz i para cieczy będą pozostawać w stanie równowagi termodynamicznej dowolnie długo.
Znaczy to, że tylko w tych warunkach ilość lodu, wody i pary pozostają dowolnie długo niezmienne.
Warto w tym miejscu zaznaczyć, że właśnie parametry punktu potrójnego wody posłużyły
za definicję bezwzględnej skali temperatur (skali Kelwina). Otóż skala Kelwina to taka skala, w której temperatura
punktu potrójnego wody wynosi 273,16K. (Z tego wynika, że zero bezwzględne to -273,15oC)
- C - tzw punkt krytyczny. Jest to temperatura, powyżej której substancji nie można już skroplić.
Pozostaje ona w stanie lotnym, niezależnie od tego, jak wielkie ciśnienie przyłożymy. Dla wody parametry punktu krytycznego to:
TK = 647,35K = 374,2oC, pK = 22131360Pa (ok. 218 razy większe niż ciśnienie atmosferyczne).
Warto zauważyć też, że odcinek A-D przedstawiający stan równowagi między lodem i wodą jest nachylony w lewo,
co jest charakterystyczne właśnie dla wody. Obrazuje to mianowicie znane zjawisko, że temperatura zamarzania wody jest pod wyższym ciśnieniem
niższa. (Dlatego jeżdżąc na łyżwach, ślizgamy się w rzeczywistości nie po lodzie, lecz po cieniutkiej warstwie wody pod łyżwami-
pod naciskiem łyżwy ciśnienie staje się za wysokie, aby w danej temperaturze woda była jeszcze zamarznięta).
Nas najbardziej interesuje w tej chwili okolica punktu A na wykresie. Ten fragment w powiększeniu przedstawiłem
poniżej, na powiększonym fragmencie górnego wykresu.
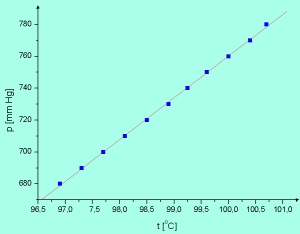
Ponieważ jest to niewielki fragment całej krzywej, jest on praktycznie prostoliniowy,
chociaż, zgodnie z teorią, opisany jest funkcją wykładniczą.
Przybliżoną zależność ciśnienia pary nasyconej od temperatury podaje wzór Clausiusa-Clapeyrona:
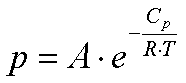
- Cp- molowe ciepło parowania,
- R- stała gazowa,
- T- temperatura[K].
We wzorze tym
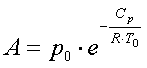
(a po i To określają warunki normalne)
CEL ĆWICZENIA
Celem ćwiczenia jest wyznaczenie zależności temperatury wrzenia wody od panującego nad jej powierzchnią ciśnienia,
sprawdzenie równania Clausiusa-Clapeyrona i wyznaczenie molowego ciepła parowania wody (Cp)
METODA POMIAROWA
Schemat układu pomiarowego przedstawiony jest na poniższym rysunku.
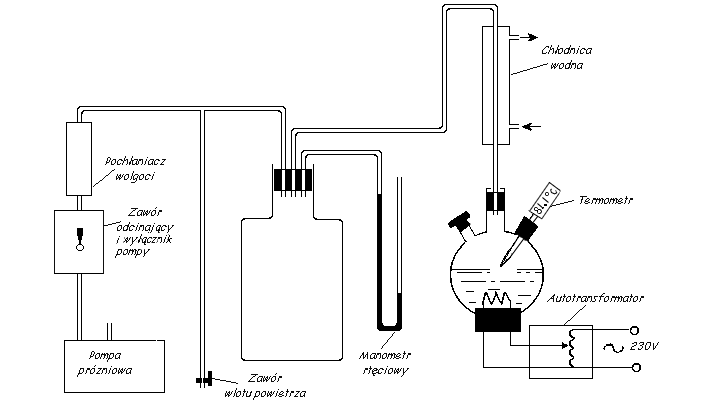
Przy pomocy pompy prózniowej wytwarzamy nad powierzchnią wody w kolbie
jak najniższe ciśnienie.
Doprowadzamy wodę do wrzenia w temperaturze pokojowej i notujemy temperaturę, w której to wrzenie następuje.
Następnie przy pomocy zaworu (plastikowy) wpuszczamy do kolby nieco powietrza, zwiększając ciśnienie powietrza
nad wodą o ok. 5cm słupa rtęci. Włączamy podgrzewanie wody w kolbie.
Gdy woda zacznie wrzeć, notujemy ponownie temperaturę wrzenia.
Czynności te te powtarzamy, do chwili osiągnięcia ciśnienia atmosferycznego.
OPRACOWANIE WYNIKÓW POMIARÓW
Należy zwrócić uwagę, że manometr M wskazuje nam wielkość podciśnienia. Właściwe ciśnienie
nad powierzchnią cieczy wynosi więc:
p = b - pM
b to ciśnienie atmosferyczne, pM ciśnienie wskazywane przez nasz manometr.
Zastosowany manometr jest manometrem rtęciowym,
odczytane ciśnienie należy więc przeliczyć z milimetrów słupa rtęci
na ciśnienie w jednostkach układu SI (w paskalach).
Tekst instrukcji stanowiskowej do ćwiczenia można pobrać tutaj
tutaj.
Wykres logarytmiczny powinien przedstawiać prostą o równaniu typu:
y= ax +b ,gdzie b=ln A, a a=-Cp/1000R
Dzieje się tak, gdyż wykres narysowano we współrzędnych [1000/T - ln p].
Zatem z nachylenia otrzymanej prostej (współczynnik a= tg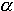 )
można wyliczyć molowe ciepło parowania Cp (Cp =E):
)
można wyliczyć molowe ciepło parowania Cp (Cp =E):
Cp= -1000 .R.a; R= 8,31 [J/(mol. K)]
Najlepiej wyznaczyć współczynniki a i b korzystając z metody regresji liniowej
("Analiza niepewności pomiarowych", str.16, rozdział I.8.2)
Obliczając odchylenie standardowe Sa określimy równocześnie niepewność wyznaczenia wartości Cp.
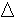 Cp=|1000. R .Sa|
Cp=|1000. R .Sa|


 Linie ciągłe na tym wykresie oznaczają odpowiednio warunki, w których następuje :
Linie ciągłe na tym wykresie oznaczają odpowiednio warunki, w których następuje :

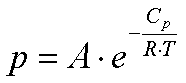
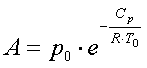

 )
można wyliczyć molowe ciepło parowania Cp (Cp =E):
)
można wyliczyć molowe ciepło parowania Cp (Cp =E): Cp=|1000. R .Sa|
Cp=|1000. R .Sa|